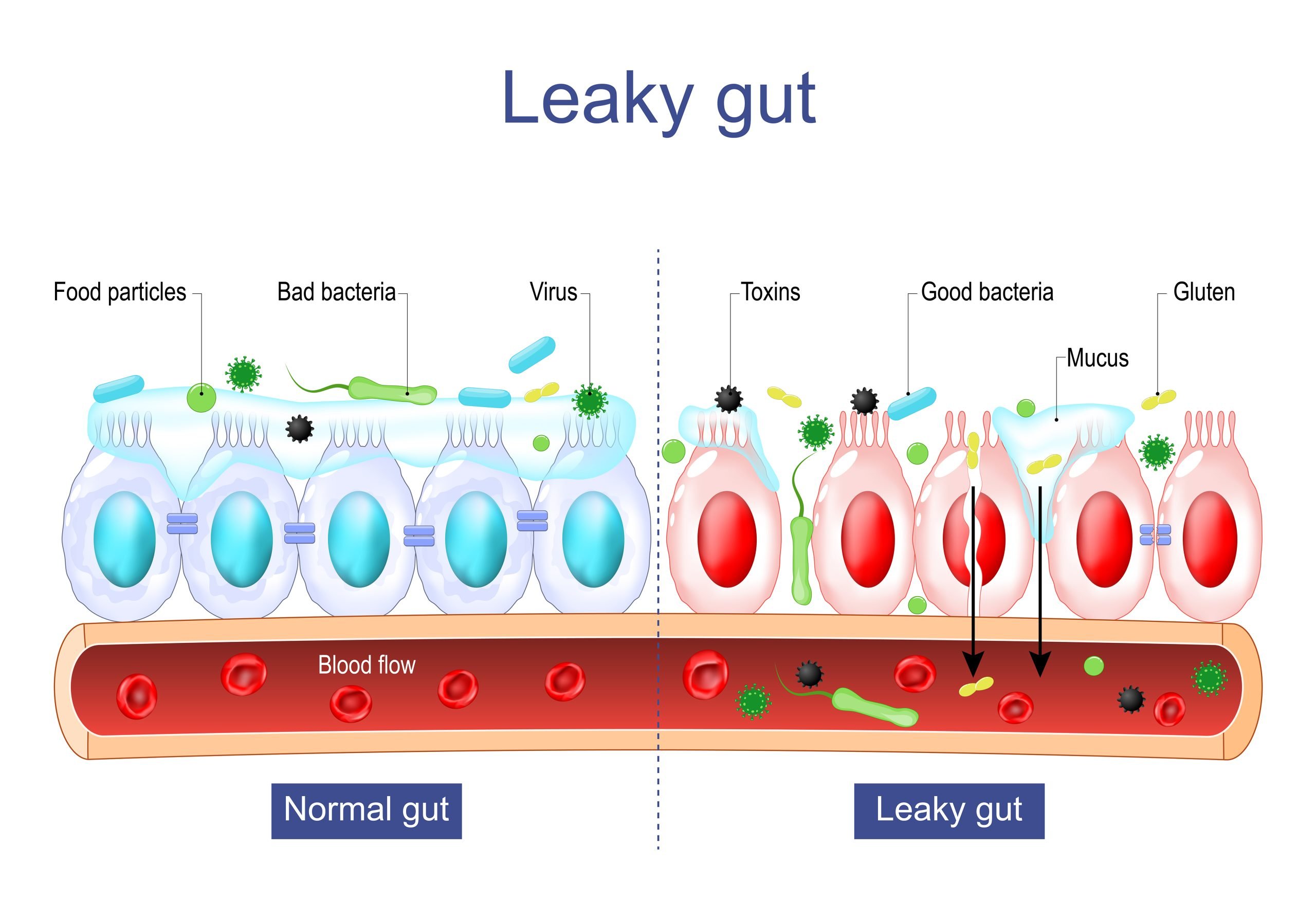
LA COMPOSITION DE LA BARRIÈRE INTESTINALE
Dans sa définition complète, la barrière intestinale est composée à la fois d'éléments physiques, mais aussi biochimiques et immunitaires. Parmi les éléments physiques, on dénombre trois couches principales interconnectées et interdépendantes qui établissent une barrière physique entre la lumière intestinale (le contenu de nos intestins) et notre milieu intérieur (l’intérieur de notre organisme):
- une couche de microbes qui est considérée comme une première barrière physique de défense et de sélection, puis
- une couche de mucus contenant aussi des germes microbiens utiles et qui empêche les grosses particules d'entrer en contact avec la couche suivante, tout en laissant passer les petites molécules, puis
- une couche de cellules épithéliales formée d’une seule épaisseur de cellules différenciées et spécialisées (cellules entérocytes, cellules de Paneth, cellules caliciformes, des cellules M, cellules dendritiques, etc.) unies les unes aux autres par des jonctions serrées imperméables pour former une barrière qui contrôle l'absorption sélective d'ions bénéfiques, de nutriments et d'autres substances.
Une grande variété de substances exogènes colonisent la lumière intestinale, telles que des micro-organismes, des toxines et des antigènes. Ces éléments sont en premier lieu dégradés par la bile, l’acide gastrique, le jus pancréatique, et les substances antimicrobiennes produites par les bactéries. C’est ensuite la barrière intestinale qui prend le relais. Si la barrière est altérée, ces substances non désirées peuvent pénétrer dans les tissus sous la paroi épithéliale intestinale, et se diffuser dangereusement dans le milieu intérieur en atteignant la circulation sanguine et lymphatique. L’interface intestinale a donc pour rôle de trier, sélectionner, laisser entrer dans le milieu intérieur ou bien de combattre les micro-organismes, les antigènes alimentaires et les toxines environnementales présents dans la lumière intestinale. La barrière est donc naturellement et sélectivement perméable pour laisser entrer dans la circulation les nutriments alimentaires essentiels, des électrolytes, des acides aminés, des acides gras à chaîne courte (AGCC) et autres métabolites microbiens, des sucres et de l’eau.
LES CAUSES DE L’HYPERPERMÉABILITÉ INTESTINALE
Lorsqu’il y a une altération de la barrière intestinale, on parle d’hyperperméabilité intestinale ou de leaky gut qui signifie « intestin qui fuit » en anglais. Cette hyperperméabilité peut avoir lieu à plusieurs niveaux : un déséquilibre au niveau microbien, une dégradation au niveau du mucus, une déficience au niveau de l’apoptose des cellules épithéliales, ou encore une augmentation de la perméabilité paracellulaire en raison de la perturbation des jonctions serrées qui lient les cellules entre elles. Les jonctions serrées sont étanches et bloquent la circulation des fluides, tout en laissant passer certains peptides (chaînes courtes d'acides aminés) de petite taille (< 15 nm). Elles garantissent aussi la stabilité du milieu intérieur en permettant que l’eau du milieu intérieur ne se déverse pas dans les intestins. Il existe des situations non pathologiques qui peuvent être associées à une perméabilité accrue, et ces perturbations relativement mineures peuvent être inversées facilement en veillant à une bonne alimentation. Cependant, l’hyperperméabilité peut être plus sérieuse et profonde lorsqu’elle est associée à des pathologies chroniques (maladie coeliaque, maladie de Crohn, etc.)
Les causes et les hypothèses de l’altération de cette barrière sont diverses :
- le stress intense, trop long, ou chronique générant une inflammation systémique et une dysbiose intestinale : ce stress peut être provoqué par une activité physique¹, par de grandes brûlures², mais aussi par des anxiétés et chocs émotionnels récurrents ;
- une alimentation très pauvre en fibres³ : les bactéries n’ayant plus de fibres à consommer, elles finissent par se nourrir de la couche de mucus de notre barrière intestinale ;
- Des allergènes comme le gluten⁴ : certaines études ont révélé que le gluten active la zonuline, une protéine qui régule les jonctions serrées de l’intestin grêle, ce qui augmente la perméabilité intestinale ;
- une dysbiose intestinale⁵ : certaines proliférations bactériennes spécifiques produisent de l’éthanol, ou encore certaines bactéries deviennent néfastes pour la barrière intestinale comme H. Pylori tout comme certains phages ;
- la consommation régulière d’alcool⁶ : elle s’accompagne d’une prolifération microbienne et d’une suppression du probiotique Lactobacillus qui augmente la perméabilité intestinale ;
- une maladie du foie⁷ : la maladie génère une inflammation systémique qui augmente la perméabilité intestinale, ce qui altère la barrière intestinale ;
- La prise d’antibiotiques⁸ : sur des sujets sains, ils augmentent la perméabilité paracellulaire de l’intestin et la diminution des expressions des protéines des jonctions étanches ;
- des médicaments anti-inflammatoires non stéroïdiens (AINS)⁹ : ils entraînent des anomalies structurelles de l’épithélium,
- etc.
LES CONSÉQUENCES DE L’HYPERPERMÉABILITÉ INTESTINALE
Lorsque la barrière intestinale devient hyperperméable, il se produit alors un passage dans la circulation sanguine de divers microbes indésirables : c'est ce que l’on appelle la translocation bactérienne. Mais l'intestin poreux laisse aussi passer des macromolécules comme des chaînes de protéines non digérées et des produits chimiques nocifs
Le docteur Jean Seignalet a mis en évidence le passage de protéines complexes non digérées comme par exemple des fragments de la longue protéine de gluten du blé. Ces fragments protéiques entrent dans la circulation générale et sont repérés comme des antigènes (éléments étrangers indésirables) qui vont amener à la production d’anticorps spécifiques chargés de les neutraliser. Si ces fragments protéiques ont des similarités avec des tissus du corps, on parle alors de mimétisme moléculaire, alors les anticorps vont attaquer par erreur les tissus qui ont des similitudes de séquence avec ces fragments étrangers. Il en résulte alors ce que l’on appelle une réaction auto-immune : le système immunitaire se retourne contre l’organisme. Les travaux de Jean Seignalet ont particulièrement porté sur une maladie auto-immune qui est la polyarthrite rhumatoïde mais il montre dans son livre L’alimentation ou la troisième médecine que le phénomène est généralisable à nombre de symptômes.
À ce titre, les recherches tendent à confirmer que l’hyperperméabilité intestinale serait à l’origine du diabète de type 1, une maladie auto-immune dans laquelle le système immunitaire attaque les cellules β pancréatiques du sujet, conduisant à une production insuffisante d’insuline par le pancréas. L’hyperperméabilité serait présente en amont de la maladie, avec une production anormale de zonuline - protéine qui régule les jonctions serrées de l’intestin grêle - par les populations microbiennes des sujets, et la présence d’une translocation microbienne contribuant au développement de la maladie¹⁰. Plus généralement, nous pouvons considérer que l’hyperperméabilité constitue la base même de l'auto-immunité.
Au delà des maladies touchant à l’immunité, l’hyperperméabilité intestinale peut être à l’origine d’une grande variété de symptômes allant des phénomènes mineurs tels que les ballonnements, les crampes, la fatigue, les gaz, les maux de tête, les allergies et intolérances alimentaires, aux pathologies plus lourdes comme le syndrome de fatigue chronique, les troubles fonctionnels de l’intestin, mais aussi la dépression, l’Alzheimer et même l’autisme.
RÉTABLIR LA BARRIÈRE INTESTINALE
voici quelques pistes spécifiques :
- Consommer plus de fibres qui alimentent les bactéries productrices de butyrate, un acide gras à chaîne courte (AGCC) qui contribue à la santé de la barrière intestinale ;
- Jeûner pour induire l’autophagie, processus reconnu pour améliorer la barrière intestinale ;
- Réduire les apports en graisses saturées (beurre, crème, graisses animales, etc.) ;
- Avoir un apport suffisant en Oméga-3, des acides gras polyinsaturés qui inhibent les phénomènes inflammatoires et empêchent les changements de la perméabilité épithéliale ;
- Retirer le gluten, les produits laitiers et les sucres raffinés, reconnus comme pro-inflammatoires et dommageables pour la barrière intestinale ;
- Consommer des probiotiques vivants, en particulier ceux contenus dans les aliments fermentés, reconnus pour améliorer l’équilibre de la perméabilité intestinale ;
- Se supplémenter si besoin avec des probiotiques comme Bacteroides fragilis qui a la capacité à modifier la composition microbienne et à améliorer la fonction de la barrière intestinale ;
- En cas de carences, se supplémenter en vitamine D, reconnue comme un protecteur de la perméabilité intestinale ;
- En cas de carences, se supplémenter en zinc, reconnu comme ayant un rôle important dans le maintien de la fonction de la barrière intestinale ;
- En cas de carences, se supplémenter avec de la L-glutamine, l’acide aminé le plus abondant dans le sang, reconnu pour jouer un rôle vital dans le maintien de l’intégrité de la barrière intestinale ;
Sources :
¹ Source : Changes in intestinal microbiota composition and metabolism coincide with increased intestinal permeability in young adults under prolonged physiological stress, 2017 (Karl et al.)
² Source : Myosin light chain kinase mediates intestinal barrier disruption following burn injury, 2012 (Chen et al.) / Burn Injury Alters the Intestinal Microbiome and Increases Gut Permeability and Bacterial Translocation, 2015 (Earley et al.)
³ Source : Characterization of gut microbiomes in nonalcoholic steatohepatitis (NASH) patients: a connection between endogenous alcohol and NASH, 2013 (Zhu et al.)
⁴ Source : Gliadin, zonulin and gut permeability: Effects on celiac and non-celiac intestinal mucosa and intestinal cell lines, 2006 (Drago et al.) / Gliadin induces an increase in intestinal permeability and zonulin release by binding to the chemokine receptor CXCR3, 2008 (Lammers et al.)
⁵ Source : A Dietary Fiber-Deprived Gut Microbiota Degrades the Colonic Mucus Barrier and Enhances Pathogen Susceptibility, 2016 (Desai et al.)
⁶ Source : Colonic microbiome is altered in alcoholism, 2012 (Mutlu et al.) / Enteric dysbiosis associated with a mouse model of alcoholic liver disease, 2011 (Yan et al.) / Diversity of tight junctions (TJs) between gastrointestinal epithelial cells and their function in maintaining the mucosal barrier, 2009 (Yu et Yang) / Bacteriophage infections of microbiota can lead to leaky gut in an experimental rodent model, 2016 (Tetz et Tetz)
⁷ Source : Hepatic Injury in Nonalcoholic Steatohepatitis Contributes to Altered Intestinal Permeability, 2015 (Luther et al.) / Bacterial translocation in patients with liver cirrhosis: physiology, clinical consequences, and practical implications, 2018 (Ponziani et al.)
⁸ Source : Antibiotics induced intestinal tight junction barrier dysfunction is associated with microbiota dysbiosis, activated NLRP3 inflammasome and autophagy, 2019 (Feng et al.) / Antibiotic Treatment Affects Intestinal Permeability and Gut Microbial Composition in Wistar Rats Dependent on Antibiotic Class, 2015 (Tulstrup et al.)
⁹ Source : Mechanisms of damage to the gastrointestinal tract from nonsteroidal anti-inflammatory drugs, 2018 (Bjarnason et al.) / Intestinal permeability and inflammation in patients on NSAIDs, 1998 (Sigthorsson et al.)
¹⁰ Source : Increased intestinal permeability as a cause of fluctuating postprandial blood glucose levels in type 1 diabetic patients, 2003 (Damci et al.) / Increased gastrointestinal permeability is an early lesion in the spontaneously diabetic BB rat, 1999 (Meddings et al.) / Ultrastructural mucosal alterations and increased intestinal permeability in non-celiac, type I diabetic patients, 2003 (Secondulfo et al.)
Cet article a été rédigé par Estelle Sovanna et il est issu du magazine Régénère n°11 "Nos précieux intestins".